Trước đó, đầu tháng 6/2022, Cục Quản lý dược đã công bố gia hạn cho 6.251 thuốc. Được biết, đây là những thuốc, vaccine, sinh phẩm có giấy đăng ký lưu hành hết hiệu lực từ 30/12/2021 đến trước 31/12/2022.
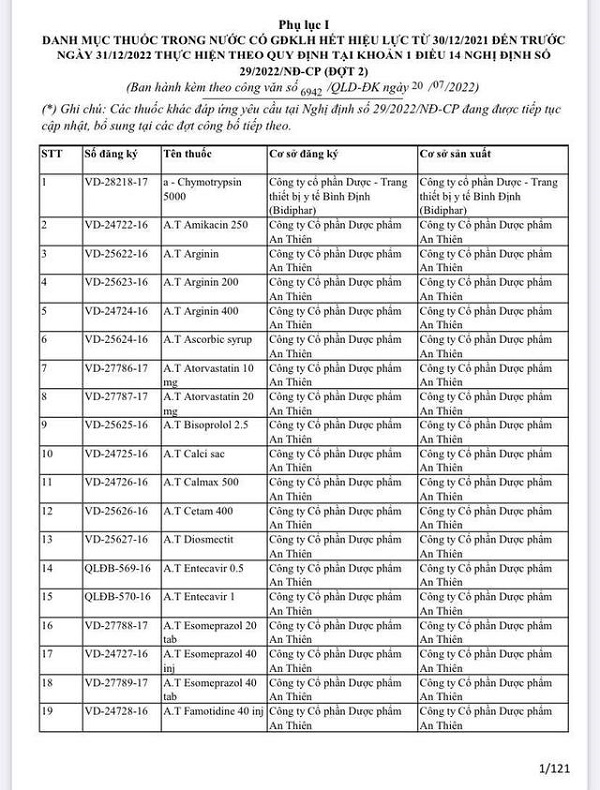
Các thuốc được gia hạn thuộc nhiều lĩnh vực điều trị khác nhau. Như vậy, trong 2 lần công bố, Bộ Y tế đã gia hạn cho tổng số 9.830 thuốc, vaccine, sinh phẩm. Đây là danh mục thuốc, vaccine, sinh phẩm có giấy đăng ký lưu hành hết hiệu lực từ 30/12/2021 đến trước 31/12/2022 thực hiện theo quy định tại Khoản 1 Điều 14 Nghị định số 29/2022/NĐ-CP của Chính phủ.
Theo Cục Quản lý dược, các thuốc khác đáp ứng yêu cầu tại Nghị định 29/2022/NĐ-CP đang tiếp tục được cập nhật và sẽ bổ sung các đợt công bố tiếp theo. Danh mục thuốc được đăng tải trên Cổng thông tin điện tử của Bộ Y tế.
Đối với các thuốc, nguyên liệu làm thuốc trong danh mục đã thực hiện thay đổi, bổ sung trong quá trình lưu hành hoặc có đính chính thông tin liên quan đến giấy đăng ký lưu hành thuốc, nguyên liệu làm thuốc, Cục Quản lý dược yêu cầu doanh nghiệp xuất trình văn bản phê duyệt hoặc xác nhận của Bộ Y tế (Cục Quản lý Dược) với các cơ quan, đơn vị liên quan để thực hiện các thủ tục theo quy định pháp luật.
Trong quá trình thực hiện nếu có khó khăn vướng mắc, đề nghị thông báo về Cục Quản lý dược để kịp thời giải quyết.
Nghị định 29/2022/NĐ-CP của Chính phủ ngày 29/4/2022 quy định chi tiết và biện pháp thi hành Nghị quyết số 12/2021/UBTVQH15 của Ủy ban thường vụ Quốc hội về việc cho phép thực hiện một số cơ chế, chính sách trong lĩnh vực y tế để phục vụ công tác phòng, chống dịch COVID-19.
Theo đó, Bộ Y tế có trách nhiệm công bố trên Cổng thông tin điện tử của Bộ danh mục các thuốc, nguyên liệu làm thuốc có giấy đăng ký lưu hành hết hiệu lực trong khoảng thời gian từ ngày Nghị quyết số 12/2021/UBTVQH15 có hiệu lực đến trước ngày 31/12/2022 nhưng do ảnh hưởng của đại dịch COVID-19 nên chưa thể hoàn thành thủ tục gia hạn đăng ký lưu hành thì được tiếp tục sử dụng đến hết ngày 31/12/2022.
Giấy đăng ký lưu hành thuốc là thủ tục xin cấp phép lưu hành trên thị trường cho các thuốc, vaccine, sinh phẩm do Bộ Y tế quản lý. Đây là hoạt động bắt buộc, theo Luật Dược.
Giấy phép lưu hành thuốc, vaccine, sinh phẩm y tế có thời hạn khác nhau, sau thời gian này, các doanh nghiệp phải làm thủ tục gia hạn, nếu không thì phải ngừng bán loại thuốc được đăng ký.
Với việc công bố này, sẽ có thêm nhiều thuốc được lưu hành trên thị trường Việt Nam (được phép mua, bán, được tham gia đấu thầu cung cấp cho các cơ sở y tế).
Trong thời gian vừa rồi, việc gia hạn giấy đăng ký lưu hành của các thuốc, vaccine, sinh phẩm hết hạn do Cục Quản lý dược thực hiện chậm. Điều này cũng là một trong những nguyên chính gây tình trạng thiếu thuốc tại các cơ sở y tế.
Đăng ký lưu hành thuốc là thủ tục xin cấp phép lưu hành trên thị trường cho các thuốc, vaccine, sinh phẩm do Bộ Y tế quản lý. Đây là hoạt động bắt buộc, theo Luật Dược. Giấy phép lưu hành thuốc do Bộ Y tế cấp có thời hạn 5 năm, doanh nghiệp phải xin gia hạn khi giấy này hết hạn, nếu không thì phải ngừng bán loại thuốc được đăng ký trong giấy phép.
Quá trình thẩm định để cấp hoặc gia hạn giấy đăng ký thuốc cần nhiều thời gian. Doanh nghiệp cần chuẩn bị khoảng 15 loại giấy tờ, như: Chứng nhận thực hành sản xuất tốt GMP, chứng nhận dược phẩm CPP, chứng nhận phân phối thuốc tốt GDP... Nếu hồ sơ đạt yêu cầu, thẩm định nhanh, sau 6 tháng Hội đồng tư vấn sẽ cấp giấy đăng ký lưu hành. Trường hợp hồ sơ không đạt yêu cầu, doanh nghiệp phải bổ sung tài liệu trong vòng 12-36 tháng mới tiếp tục được xem xét giải quyết.
Ngân Phương














