Theo nội dung Quyết định, việc thu hồi giấy đăng ký lưu hành được căn cứ theo các quy định hiện hành, trong đó có Thông tư số 08/2022/TT-BYT ngày 5/9/2022 của Bộ trưởng Bộ Y tế về việc đăng ký lưu hành thuốc và nguyên liệu làm thuốc. Lý do thu hồi không bắt nguồn từ vi phạm chất lượng hay an toàn, mà hoàn toàn do đề nghị từ phía doanh nghiệp – một điểm đáng lưu ý trong bối cảnh thị trường dược phẩm đang chứng kiến nhiều thay đổi về định hướng sản phẩm và cơ cấu danh mục đầu tư.
 |
| Thu hồi giấy đăng ký lưu hành thuốc điều trị rối loạn cương dương của Meyer-BPC |
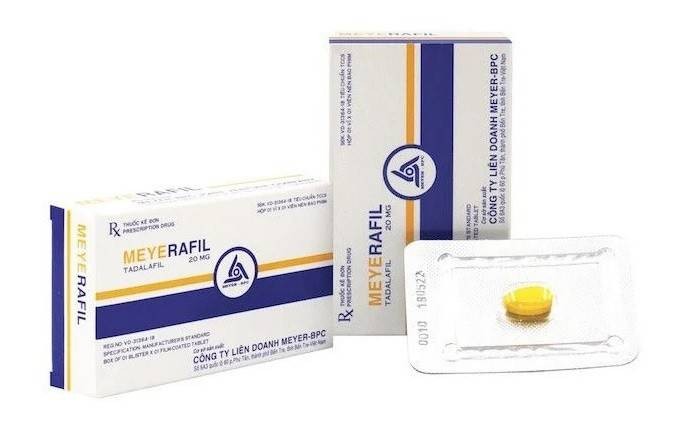
1. Tadalafil 20mg, dạng viên nén bao phim
Sản phẩm này do Công ty Liên doanh Meyer-BPC đăng ký và trực tiếp sản xuất tại nhà máy đặt tại số 643, quốc lộ 60, phường Phú Tân, thành phố Bến Tre, tỉnh Bến Tre. Thuốc từng được cấp số đăng ký mới là 893110457024, trước đó mang mã VD-31364-18. Tadalafil thường được biết đến với tác dụng điều trị rối loạn cương dương ở nam giới.
2. Odistad 120, dạng viên nang cứng
Sản phẩm do Công ty TNHH Liên doanh Stellapharm đăng ký, được sản xuất tại Chi nhánh 1 của công ty – đặt tại khu công nghiệp Việt Nam - Singapore, phường An Phú, thành phố Thuận An, tỉnh Bình Dương. Thuốc có số đăng ký hiện tại là 893100515124, mã cũ VD-21535-14. Odistad 120 chứa hoạt chất hỗ trợ kiểm soát cân nặng, thường được chỉ định trong điều trị béo phì.
3. Vacobufen 400, dạng viên nén bao phim
Đây là sản phẩm của Công ty cổ phần Dược Vacopharm, có cả cơ sở đăng ký và sản xuất đặt tại thành phố Tân An, tỉnh Long An. Số đăng ký của thuốc là 893100032324. Vacobufen 400 chứa Ibuprofen – một hoạt chất chống viêm không steroid (NSAID), thường được sử dụng để giảm đau và hạ sốt.
Dù bị thu hồi giấy đăng ký lưu hành, các lô thuốc đã sản xuất trước ngày quyết định có hiệu lực vẫn được phép tiếp tục lưu hành trên thị trường cho đến khi hết hạn sử dụng. Tuy nhiên, theo quy định của Bộ Y tế, các doanh nghiệp đăng ký và sản xuất thuốc vẫn phải chịu trách nhiệm đầy đủ về chất lượng, độ an toàn và hiệu quả điều trị của sản phẩm trong suốt quá trình lưu hành còn lại.
Cùng với đó, Giám đốc Sở Y tế các tỉnh, thành phố trực thuộc Trung ương, các cơ sở kinh doanh dược phẩm, cũng như lãnh đạo các công ty có thuốc bị thu hồi, đều được yêu cầu nghiêm túc thực hiện nội dung của quyết định theo đúng chức năng và trách nhiệm được phân công.














